
의약품 제조 과정에서 가장 중요한 부분 중 하나는 ‘안전’입니다.
우리나라는 안전한 의약품 제조를 위해 의약품을 만드는 원료부터 안전성을 검토하고 심사하는 제도가 있습니다. 바로 원료의약품 등록 제도(DMF, Drug Master File)데요!
오늘 [헬스케어 용어 상식]에서는 원료의약품 등록 제도(DMF)의 정의와 원료약품과 원료의약품의 차이, 원료의약품 등록 제도(DMF) 절차까지 자세히 알아보겠습니다!
원료의약품 등록 제도(DMF)란?

원료의약품 등록 제도(DMF, Drug Master File)는 의약품의 품질을 보다 철저하게 관리하기 위해 완제의약품을 제조할 때 등록된 주성분만을 사용하도록 의무화한 제도입니다.
우리나라는 2002년 7월부터 도입하여 완제의약품을 만드는 과정에서 일정 수준 이하의 원료의약품 사용을 차단하고 있는데요. 원료의약품 등록 제도를 통해 원료의약품 ‘제조’와 ‘품질관리’의 적정성을 검토해 안전성과 투명성을 확보할 수 있습니다.
잠깐! 원료약품, 원료의약품, 완제의약품의 차이는?

그렇다면, 원료의약품이란 무엇일까요? 원료의약품과 원료약품은 다른 것일까요? 완제의약품의 정의까지 한 번에 살펴보겠습니다.
▲원료약품은 원료의약품을 만드는 데 사용하는 물질을 말합니다. 원료약품은 최종 원료의약품에 남아있지 않은 물질도 포함하는 개념입니다. ▲원료의약품은 합성, 발효, 추출 등 또는 이들의 조합에 의하여 제조된 물질로, 완제의약품을 생산하는 데 사용하는 원료를 말합니다. ▲완제의약품은 모든 제조공정이 완료되어 최종적으로 인체에 투여할 수 있도록 제조된 의약품입니다.
- 👉 관련 콘텐츠 보러가기 (CLICK!)
- [제약산업 용어 상식] 원료의약품
원료의약품 등록 제도(DMF) 절차, 쉽게 설명해드립니다!
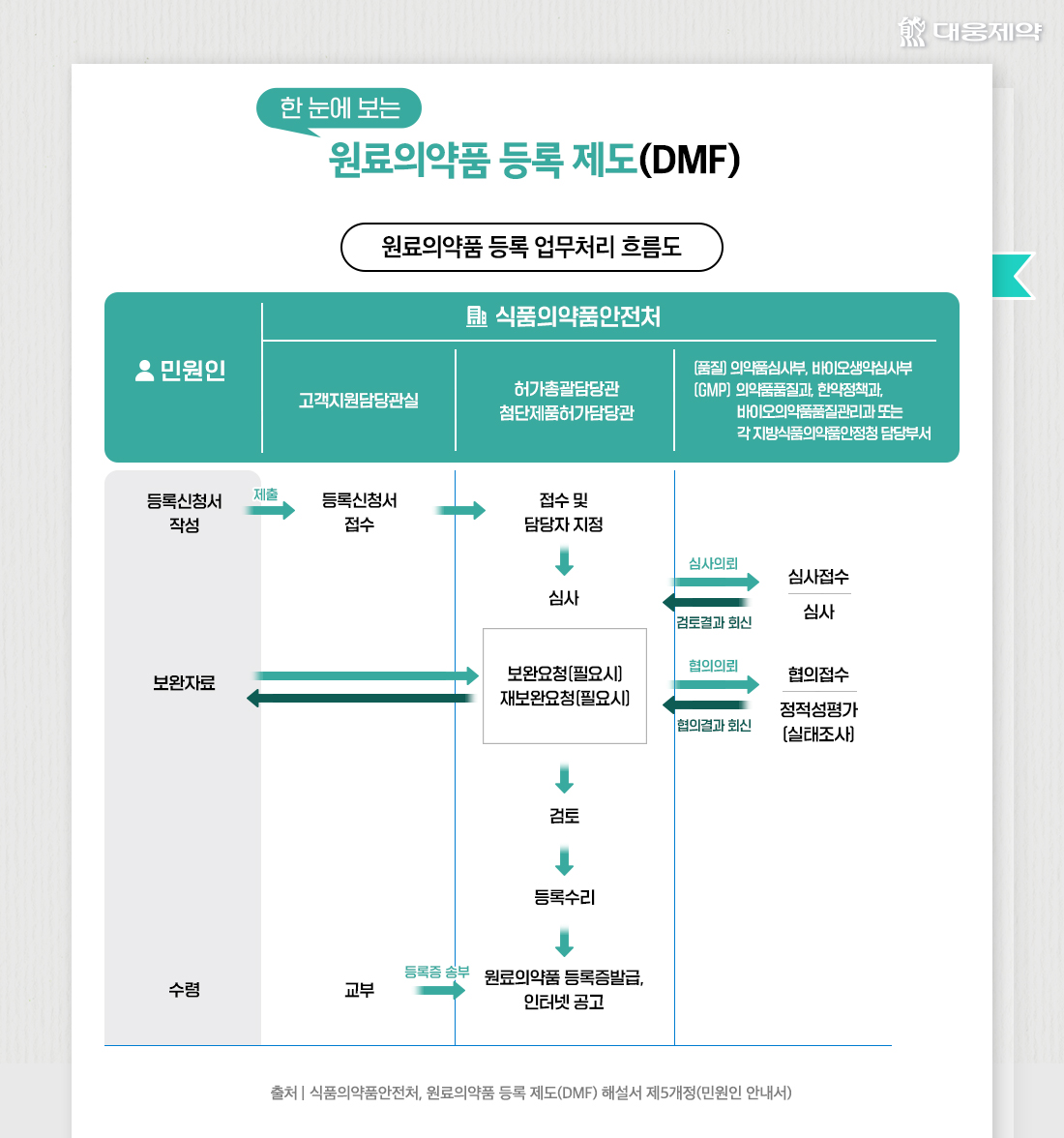
1단계. 등록 신청서 접수
원료의약품 등록신청서를 비롯해 원료의약품 생산에 사용하는 생산설비, 반응공정, 포장, 저장 방법, 공정에 사용한 모든 물질의 규격 등 관련 세부 자료를 식품의약품안전처에 제출합니다.
2단계. 검토 및 심사
제출한 서류와 모든 관련 자료는 식품의약품안전처에서 검토합니다. 이 과정에서 서류 심사와 함께 제대로 된 원료의약품을 만들기 위해 GMP 공정을 거치는지 등을 확인하는 현장 실사도 진행합니다. 이후 검토가 끝나면, 원료의약품으로 적합한지를 심사합니다.
3단계. 식품의약품안전처 홈페이지 공고
심사 후 적합 판정을 받은 원료의약품은 성분 이름, 제조소 이름, 제조소 위치 등의 정보를 식품의약품안전처 홈페이지에 공고합니다.
따라서 완제의약품을 제조하는 제약회사들은 원료의약품을 사용하기 전 식품의약품안전처 홈페이지 검색을 통해 쓸 수 있는 원료인지 미리 확인하는 것이 좋습니다.
다만, 식품의약품안전처가 고시한 「원료의약품 등록에 관한 규정」에 따라 원료의약품 등록 대상에서 제외하는 경우도 있습니다. 희귀의약품, 유전자재조합의약품, 세포배양의약품·생물학적제제·세포치료제·유전자치료제, 방사성의약품, 수출용의약품, 약리 활성이 없는 성분(부형제, 첨가제 등) 등이 이에 해당합니다.
그러므로 원료의약품 등록 제도(DMF)의 신청 전, 제외 항목에 해당하는지 미리 확인하는 것이 좋습니다.
지금까지 원료의약품 등록 제도(DMF)에 대해 알아봤습니다.
원료의약품 등록 제도(DMF)는 안전한 완제의약품의 생산을 위해 필요한 과정인 만큼 의약품을 개발하기 전 식품의약품안전처 홈페이지를 통해 사용하려는 원료의약품이 적정성을 확인해보시기를 바랍니다!

-
연관 콘텐츠
-
인사이트
-
-
최신 콘텐츠




