
폐는 들숨과 날숨으로 산소를 얻고 이산화탄소를 배출하는 기관으로 호흡을 담당하는 필수 기관입니다.
폐에 문제가 생기면 생명을 위협하기도 하죠. 아직까지 원인이 명확하지 않고 치료가 어려운 희귀질환, ‘특발성 폐섬유증’도 그중 하나입니다.
오늘 대웅제약 뉴스룸에서는 많은 제약∙바이오 기업들이 신약 개발에 속도를 올리고 있는 특발성 폐섬유증의 개념과 대웅제약이 세계 최초 혁신 신약(First-in-class)으로 자체 개발 중인 특발성 폐섬유증 신약 후보물질 ‘베르시포로신(Bersiporocin, DWN12088)’ 개발 현황까지 함께 살펴보겠습니다.
‘특발성 폐섬유증’이란?
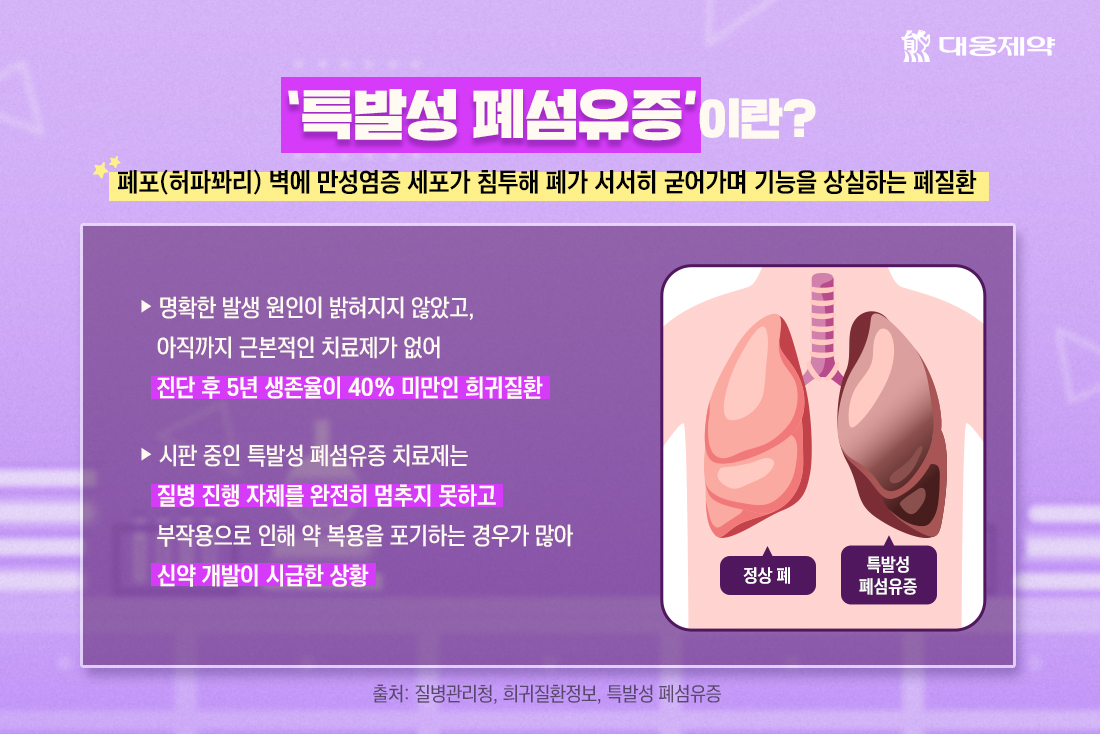
특발성 폐섬유증(Idiopathic Pulmonary Fibrosis; IPF)은 폐포(허파꽈리) 벽에 만성염증 세포가 침투해 폐가 서서히 굳어가며 기능을 상실하는 폐질환입니다.
특발성 폐섬유증은 현재까지 밝혀진 뚜렷한 원인이 없습니다. 질환 이름에 나타나는 ‘특발성’이란 ‘원인을 모른다’는 뜻입니다. 다만, 이 질환에 걸릴 확률을 높이는 것으로 알려진 위험인자에는 ① 흡연 ② 대기오염, ③ 분진에 자주 노출되는 환경, ④ 바이러스 감염, ⑤ 미세 유해물질 흡인이 있습니다.
특발성 폐섬유증은 아직 근본적인 치료제가 없고 치료가 어려워 진단 후 5년 생존율이 40% 미만에 불과합니다. 현재 시판 중인 특발성 폐섬유증 치료제는 질병 진행 자체를 완전히 멈추지 못하고 부작용으로 인해 약 복용을 포기하는 경우가 많아 신약 개발이 시급한 상황입니다.
‘특발성 폐섬유증’의 증상은?

폐가 서서히 굳어가며 기능을 잃는 특발성 폐섬유증의 증상은 무엇인지 살펴보겠습니다.
우선 1~2년에 걸쳐 마른기침이 서서히 발생하고, 운동할 때 호흡 곤란이 생깁니다. 병이 진행될수록 호흡 곤란이 심해져 일상생활이 점점 힘들어지고, 저산소증이 올 수 있습니다. 또한, 환자의 손가락 끝이 뭉툭해지는 곤봉지가 발견되기도 합니다.
진찰 시에는 양쪽 폐의 아래 부위에서 특징적인 수포음이 들릴 수 있습니다. 특발성 폐섬유증이 말기로 향하면 간이 비대해지고 전신 부종 등의 우심부전 증상이 관찰됩니다.
글로벌 ‘특발성 폐섬유증 치료제’의 전망
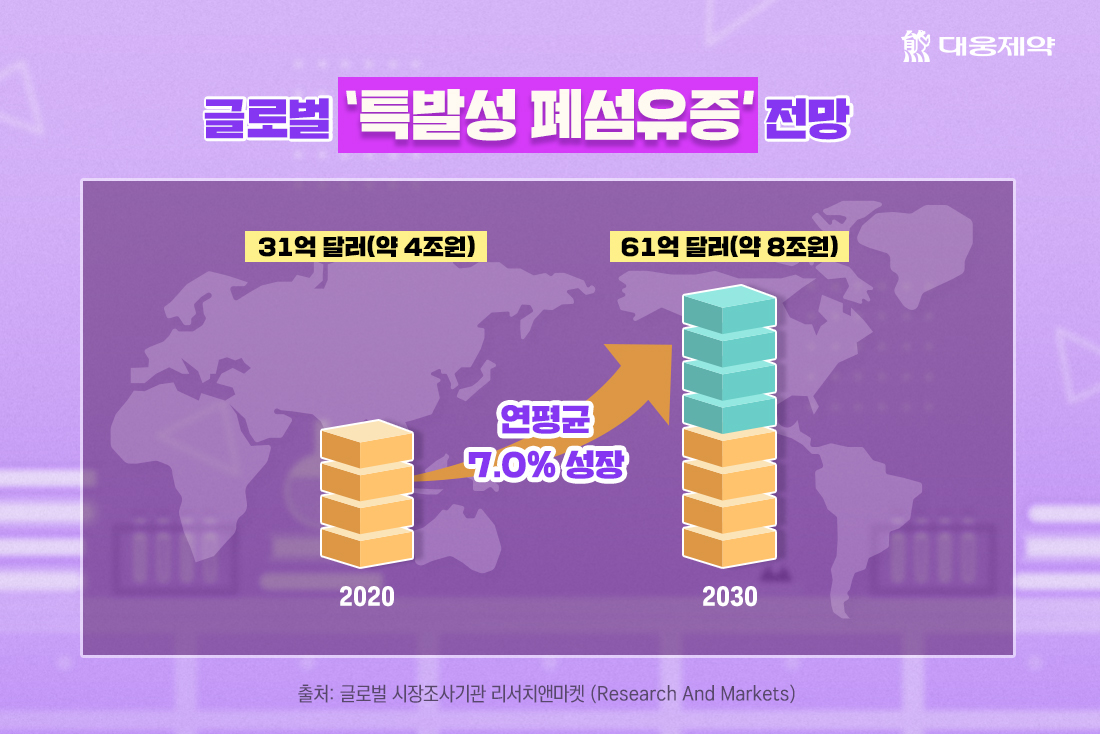
글로벌 시장조사기관 리서치앤마켓 (Research And Markets)에 따르면, 특발성 폐섬유증 치료제 시장은 매년 7%의 높은 성장률을 보이며 2020년은 31억 달러(약 4조원)이던 시장 규모가 2030년에는 61억 달러(약 8조원)에 달할 것으로 전망되고 있습니다.
대웅제약의 특발성 폐섬유증 신약 후보물질 ‘베르시포로신(Bersiporocin, DWN12088)’ 개발 현황

그렇다면 대웅제약은 특발성 폐섬유증을 극복하기 위해 어떤 신약을 개발하고 있을까요?
바로 특발성 폐섬유증 신약 후보물질 ‘베르시포로신(Bersiporocin, DWN12088)’입니다. 베르시포로신은 세계 최초 혁신 신약(First-in-class)으로 자체 개발 중인 섬유증 치료제로 PRS(Prolyl-tRNA Synthetase) 저해 항섬유화제 신약입니다. 콜라겐 생성과 섬유화 유발 인자 생성에 영향을 주는 PRS 단백질의 작용을 감소시켜 섬유증의 원인이 되는 콜라겐의 과도한 생성을 억제합니다.
베르시포로신은 2017년 11월 미국 심장학회에서 심장섬유화 치료제로써 전임상 결과를 발표해 그 존재를 알리기 시작했습니다. 심부전증이 발생한 동물에 베르시포로신을 경구 투여한 결과, 체중 1kg당 1mg의 소량만으로도 심장섬유증 현상을 효과적으로 억제하고 인체 심장 세포에 대해서도 항섬유화 효능이 나타났습니다.
그 성과를 인정받아 2019년 3월에는 범부처신약개발사업단이 주관한 혁신형 글로벌 신약개발사업 부문의 지원 대상으로 채택되었고, 2019년 8월에는 미국 식품의약국(FDA) 희귀의약품으로 지정되는 쾌거를 달성했는데요! 이를 계기로 ▲신약 허가 심사 비용 면제 ▲우선 심사 신청권 ▲시판허가 승인 시 7년간 독점권 인정 등의 혜택을 부여받게 되었습니다.
2022년 6월에는 미국 식품의약국(FDA)으로부터 특발성 폐섬유증 환자를 대상으로 하는 임상 2상 시험계획(IND)을 승인받아 미국과 한국에서 동시에 임상을 진행해 안전성과 효능을 평가하게 되었습니다.
뒤이어 7월에는 국내 특발성 폐섬유증 신약 최초로 미국 식품의약국(FDA)의 패스트 트랙으로 지정되었는데요! 이로써 FDA와 개발 각 단계마다 임상 설계에 대한 상담과 조언 청취와 같은 긴밀한 협의가 가능해졌습니다.
그리고 지난 11월에는 국가신약개발사업단의 국가신약개발사업 지원 과제로 선정되어 앞으로 2년간 임상 시험 진행을 위한 연구비를 지원받게 되었습니다.
오늘은 원인도 밝혀지지 않았고 근본적인 치료가 어려워 진단 후 5년 생존율이 40% 미만에 불과한 희귀질환, 특발성 폐섬유증에 대해 알아봤습니다.
대웅제약이 세계 최초 혁신 신약(First-in-class)으로 자체 개발 중인 특발성 폐섬유증 신약 후보물질 ‘베르시포로신’이 상용화되는 그날까지 대웅제약의 발걸음을 관심 있게 지켜봐 주시기 바랍니다.


-
연관 콘텐츠
-
최신 콘텐츠




