
제약업계 뉴스를 보면 자주 눈에 띄는 용어, 신약 파이프라인은 연구개발중인 신약개발 프로젝트를 말합니다. ‘신약 파이프라인을 확대하기 위해 노력했다’는 말은 더 많은 종류의 신약을 개발하기 위해 노력하고 있다는 의미인 것이죠. 신약 파이프라인은 곧 제약산업의 경쟁력과도 직결될 정도로 중요한 부분인데요. 대웅제약은 어떤 신약 파이프라인을 보유하고 있을까요? 각 임상 단계별로 대웅제약이 개발 중인 신약 파이프라인을 알아보겠습니다!
신약 파이프라인 진행과정은?
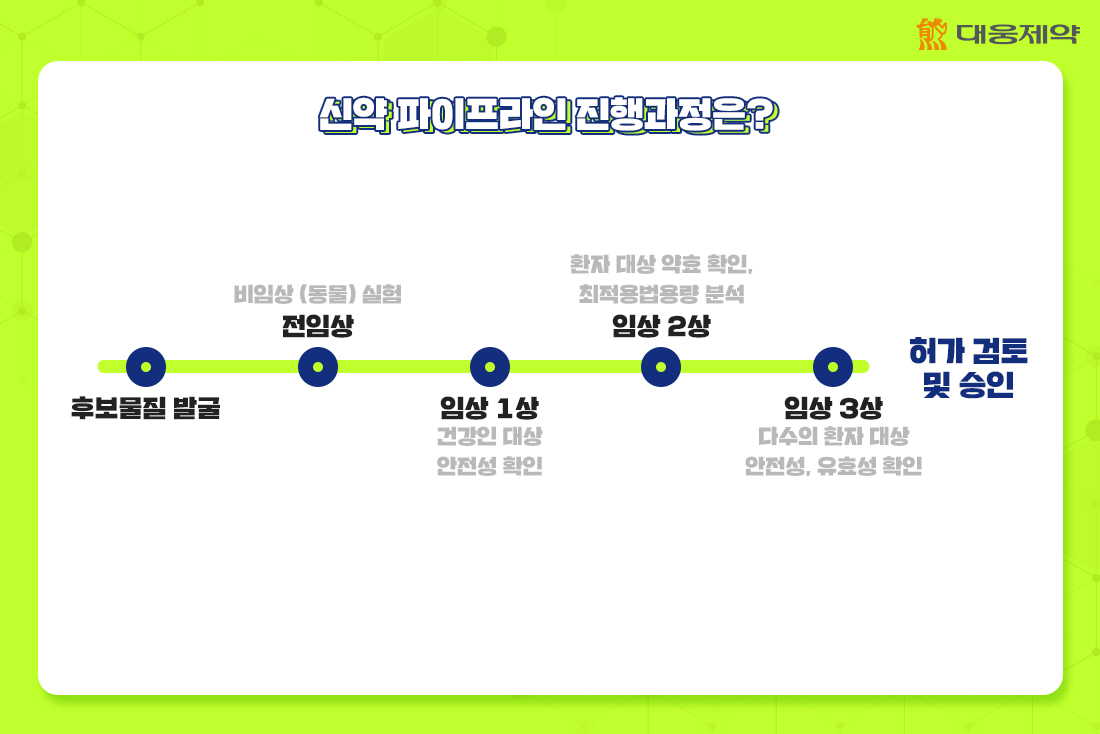
임상 단계별 대웅제약의 신약 파이프라인에 대해 알기 위해서는 신약은 어떤 과정을 통해 개발되는지 먼저 알아야겠죠? 신약 파이프라인의 연구는 크게 5가지 단계로 이뤄져 있습니다. 연구(후보물질 도출), 전임상, 임상 1상, 임상 2상, 임상 3상 순으로 진행되죠.
새로운 치료제 개발을 위한 후보물질을 발견하면, ‘전임상’ 단계로 임상 1상시험을 위한 비임상(동물) 실험을 수행합니다. 그 다음, 임상 1상에서는 건강한 사람에게 의약품이 안전한지를 확인합니다. ‘임상 2상’에서는 임상시험용 의약품이 환자를 대상으로 약효가 있는지 검토하고, 의약품 사용에 있어 최적 용량과 투약 방법을 분석합니다. ‘임상3상’은 대규모 환자를 대상으로 후보 의약품의 안전성과 유효성을 확인하여 최종적으로 약품 설명서 (Label)를 만드는 단계죠.
이러한 연구개발 과정을 거쳐 안전성과 유효성, 품질에 대한 입증자료를 식품의약품안전처에 제출해 심사를 거쳐 허가 승인을 받게 됩니다.
전임상 – 자가면역질환 치료제 ‘DWP212525’, ‘DWP213388’

자가면역치료제 ‘DWP212525’와 ‘DWP213388’은 전임상 단계에 있습니다. 전임상을 통해 루프스, 아토피 피부염, 류마티스 관절염 등에 효능 및 치료제로서 가능성을 확인했죠. ‘DWP213388’은 올해 1상 진입, ‘DWP212525’는 올해 전임상 완료 후 내년에 임상 1상에 진입할 계획입니다.
임상 1상- 세계 최초 PRS 억제 섬유증 치료신약으로 개발 중인 ‘DWN12088’
세계 최초로 PRS(Prolyl-tRNA Synthetase) 단백질을 저해하는 섬유증 치료제로 ‘DWN12088’을 개발하고 있습니다.
호주에서 건강한 사람을 대상으로 임상 1상을 마친 상태죠. 임상 1상에서는 ‘DWN12088’의 안전성과 함께 체내 흡수, 분포, 대사 등 약동학적 특성을 파악했습니다. 올해 안에 우리나라와 미국에서 임상 2상을 통해 특발성 폐섬유증 환자를 대상으로 PRS 저해에 따른 폐섬유증의 개선을 확인할 계획입니다.
게다가 최근 좋은 소식이 전해졌는데요! 미국 식품의약국(FDA)에서 전신피부경화증에 대한 희귀의약품으로 추가 지정했습니다. 2019년 특발성 폐섬유증으로 희귀의약품으로 지정된 후 두 번째 쾌거입니다.
임상 2 상 – 궤양성 대장염 치료제 ‘DWP305401’

대웅제약은 브릿지바이오사와 함께 궤양성 대장염 치료제로 ‘DWP305401’을 개발하고 있습니다. 면역 신호 전달에 관여하는 단백질 펠리노-1과 결합해 궤양성 대장염 등 염증성 질환에서 염증 신호 전달을 차단해 항염 효과를 나타내는 기전의 약물입니다. 계열 내 최초(First-in-Class) 신약 후보물질로 개발 중인데요. 현재 궤양성 대장염 환자를 대상으로 3가지 용량으로 2a상 시험을 진행하고 있습니다.
임상 3상 – 제2형 당뇨병 치료제 ‘이나보글리플로진’

‘이나보글리플로진’은 경구용 제2형 당뇨병 치료제인데요.
임상 2상을 통해 3가지 용량으로 시험한 결과 제2형 당뇨병 환자의 혈당 강하 효과와 안전성을 확인했습니다. 12주 동안 투여한 결과 제2형 당뇨병 환자의 당화혈색소가 비교군 대비 30% 이상 감소했고, 글로벌 기준의 당뇨병 조절 목표인 ‘당화혈색소 7.0% 이하’에 도달한 환자 비율의 경우 비교군이 평균 30%에 비해 이나보글리플로진은 최대 61%, 치료 전 대비 당화혈색소 0.5% 초과 감소한 환자 비율은 비교군 60%에 비해 이나보글리플로진은 최대 72%에 달했습니다.
현재는 실제 허가를 목표로 적응증 확보를 위해 국내에서 단독 투여, 메트포르민과 병용요법, 메트포르민∙DPP-4 억제제 3제 병용요법에 대한 3상 임상 계획을 승인받아 진행 중입니다.
허가 신청- 위식도역류질환 치료제 ‘펙수프라잔’

위식도역류질환 치료제 신약 ‘펙수프라잔’은 역류성 식도염 중 미란성 식도염 증상에 대해 국내 임상 3상까지 완료됐습니다. 올해 펙수프라잔의 허가를 획득하는 것을 목표로 매진하고 있습니다.
임상 결과를 보면 펙수프라잔은 8주까지 내시경상 점막 결손 치료에 있어 99%의 높은 치료율을 나타냈습니다. 환자가 약을 복용할 때 불편함이나 부작용이 적은 양호한 내약성과 안전성도 확인했죠. 뿐만 아니라 투여 초기부터 주․야간에 상관없이 즉시 가슴쓰림 증상 개선을 보였고, 위식도역류질환의 비전형적 증상 중 하나인 기침 증상도 개선됐습니다.
대웅제약은 미국·중국·브라질·멕시코에 이어 최근 콜롬비아·에콰도르·페루·칠레까지 기술 수출 계약을 체결하며 펙수프라잔의 해외 진출도 확대해나가고 있습니다. 현재까지 펙수프라잔의 전 세계 기술수출 계약 금액은 1조 370억원에 이릅니다.
이처럼 임상 단계별 대웅제약의 신약 파이프라인에 대해 살펴봤습니다. 후보물질 연구부터 임상 1상, 2상, 3상 식약처의 심사까지 신약 하나가 개발되기까지는 오랜 시간 수많은 이들의 노력이 필요한데요. 자가면역질환, 당뇨병, 섬유증, 위식도역류질환 등으로 고통받는 이들이 건강을 되찾을 때까지 대웅제약의 노력은 계속됩니다!

-
연관 콘텐츠
-
최신 콘텐츠




