
2009년, 멕시코의 돼지농장에서 발생한 바이러스가 사람에게 옮겨온 ‘돼지독감’으로 한바탕 홍역을 치뤘던 ‘신종플루 사태’, 다들 기억하실 겁니다. 당시 백신을 생산하는 선진국들은 자체생산을 통해 우선적으로 백신을 확보할 수 있었지만, 한국은 백신 생산 자급능력이 충분하지 않아 글로벌 백신 생산 제약사가 있는 나라로 사절단을 급파하여 백신을 구해오기도 했습니다.
이처럼 백신 주권 확보는 국민의 생명과 건강을 수호하는 필수적인 사회 안전망으로, 신종플루 사태는 자국 생산 의약품의 중요성을 절감하게 했던 사건이라 할 수 있습니다. UN은 공장 등 의약품의 자체 생산능력 보유 여부가 그 나라 국민의 건강권을 확보하기 위한 필수요소라고 강조하고 있기도 합니다.
그렇다면, 그 후 10년이 지난 지금. 자국 생산 의약품을 비롯한 우리나라의 제약산업은 어디까지 왔을까요? 제약산업의 R&D(연구·개발) 및 동향 등을 분석해 보았습니다.
국내 제약산업 연구개발(R&D)의 시작
국내에서 신약 연구개발을 본격화한 시점은 우리나라에 물질특허가 도입된 1987년으로 거슬러 올라갑니다. 의약품 특허를 받으면 20년간 독점권을 확보할 수 있어 장기간 안정적인 수익이 보장됩니다. 따라서 물질특허 도입은 이전까지 오리지널 의약품을 복제하는 ‘제네릭’ 중심에 그쳤던 국내 제약사들에게 신약 연구개발을 촉발시키는 기폭제로 작용하였습니다.
1999년 토종 신약 1호 ‘선플라주’와 함께 2001년 대웅제약의 ‘이지에프(외용액)’ 등으로 신약개발국의 지위를 얻게 된 한국은 1999년부터 2019년 2월까지 30개의 국산신약을 탄생시켰습니다.

글로벌 시장을 겨냥하고 있는 신약 연구개발
국내에서 신약 연구개발을 시작한지 30년이 지난 지금, 이제 국내 제약사들은 한국 시장을 넘어 세계시장으로 속속 진출하고 있습니다. 실제로, ‘제네릭(복제약)’중심이던 국내 제약산업은 2,000년대 이후 글로벌 시장을 겨냥한 신약 연구개발을 본격 추진하면서 수출규모가 5배이상 뛰는 성장산업으로 자리매김하고 있으며, 1,000개가 넘는 신약후보 물질(파이프라인)이 가동되고 있습니다.
이 과정에서 단순히 수가 많아지는 수준에서 탈피해 국내 연구개발 신약이 글로벌 무대에 당당히 이름을 올리고 있다는 점에서 주목할만합니다. 대표적으로 의약선진국인 미국에 시판 허가를 받은 대웅제약의 ‘나보타’가 있습니다.
신약개발 A to Z
다만, 신약개발은 1만여 개의 후보물질을 탐색하는 신약 개발의 첫 단계부터 신약으로 인정받는 마지막 승인 단계까지 최소 10년 이상 시간이 소요되므로 장기적 관점에서 바라보는 것이 중요합니다. 의약품의 허가 및 시판을 위해서는 반드시 거쳐야 하는 임상시험이 가장 큰 장애물로 작용하기 때문입니다. 임상은 동물을 대상으로 한 전임상과 건강한 사람을 대상으로 약물의 효능과 독성, 부작용 등을 관찰하는 임상1상, 환자를 대상으로 한 임상2상과 임상3상을 거쳐야 합니다.
특히, 임상3상은 효능뿐만 아니라 장기적인 안정성도 입증해야 해 피험자 수가 2상보다 많고 기간도 훨씬 더 깁니다. 현재 국내 제약사들의 신약 후보물질의 연구 단계를 보면 전임상이나 임상 1~2상이 대부분인 이유도 바로 임상3상에 가장 많은 시간이 들기 때문이라 할 수 있습니다.
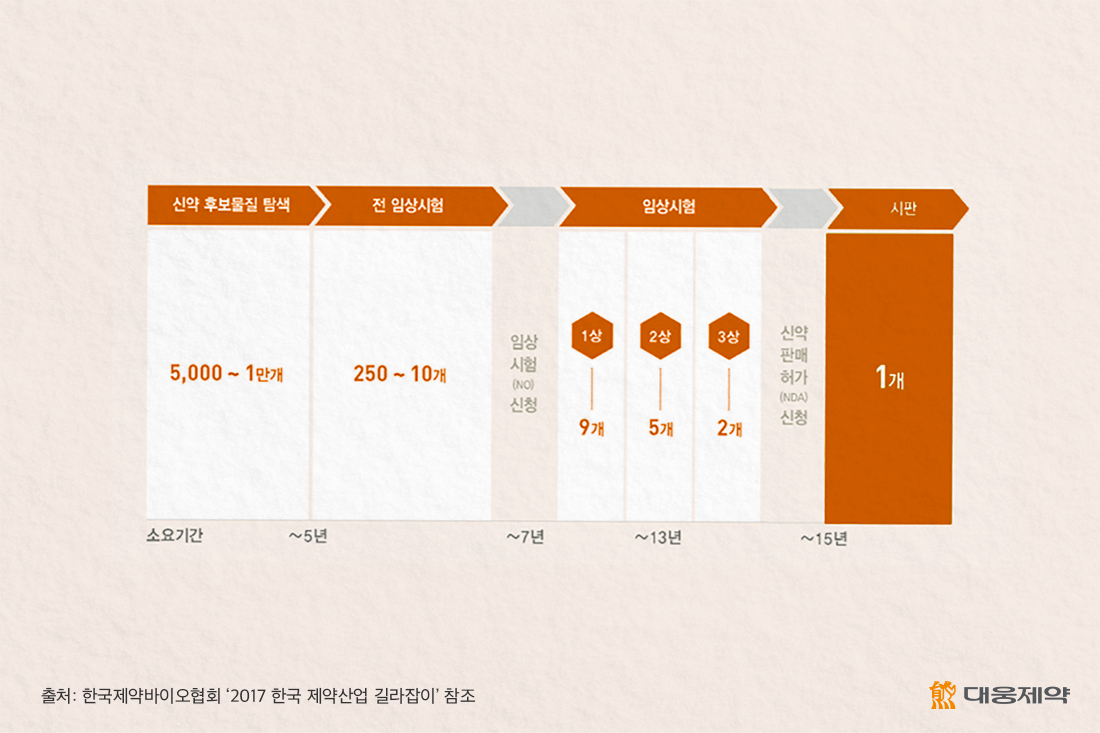
– 전 임상시험(비임상시험)
후보물질의 독성과 유효성을 평가하는 단계로 동물 또는 세포를 대상으로 시험, 후보물질의 부작용 여부 등을 확인하는 단계
– 제1상 임상시험
건강한 사람 20~80명을 대상으로 약물을 안전하게 투여할 수 있는 용량과 인체내 약물 흡수정도 등을 평가
– 제2상 임상시험
100~200명, 혹은 수백명의 소규모 환자들을 대상으로 약물의 약효와 부작용을 평가하고, 유효성을 검증
– 제3상 임상시험
신약의 유효성이 어느정도 확립된 후에 대규모(최소 수백 명에서 수천 명) 환자들을 대상으로 장기 투여시 안전성 등 검토와 확고한 증거 수집 위해 실시
– 제4상 임상시험
신약이 시판 사용된 후 장기간의 효능과 안전성에 관한 사항을 평가하기 위한 시험으로 시판 후 조사(Post marketing Surveillance)등 포함
국내 제약사들의 R&D 투자 경쟁
신약 개발은 시간뿐만 아니라 적게는 수천억 원, 많게는 수조 원에 이를 정도로 막대한 비용이 듭니다. 그나마 신약 개발이 최종적으로 성공하지 못하면 모든 투자가 물거품이 될 수도 있습니다. 특히, 매년 천문학적인 연구개발비를 신약 개발에 쏟아붓고 있는 글로벌 제약기업들에 비하면, 국내 제약기업의 신약개발 투자는 명백한 열세에 있습니다. 국내 제약기업 모두의 총 연간 연구개발비를 더해도, 로슈, 노바티스 등과 같은 세계적인 제약사 한 곳의 연구개발비에도 훨씬 못 미치는 수준이기 때문입니다. 그러나 국내 제약사들은 매년 연구개발 투자를 지속적으로 확대하고 있으며, 혁신 신약 개발에 한 걸음씩 다가서고 있습니다.
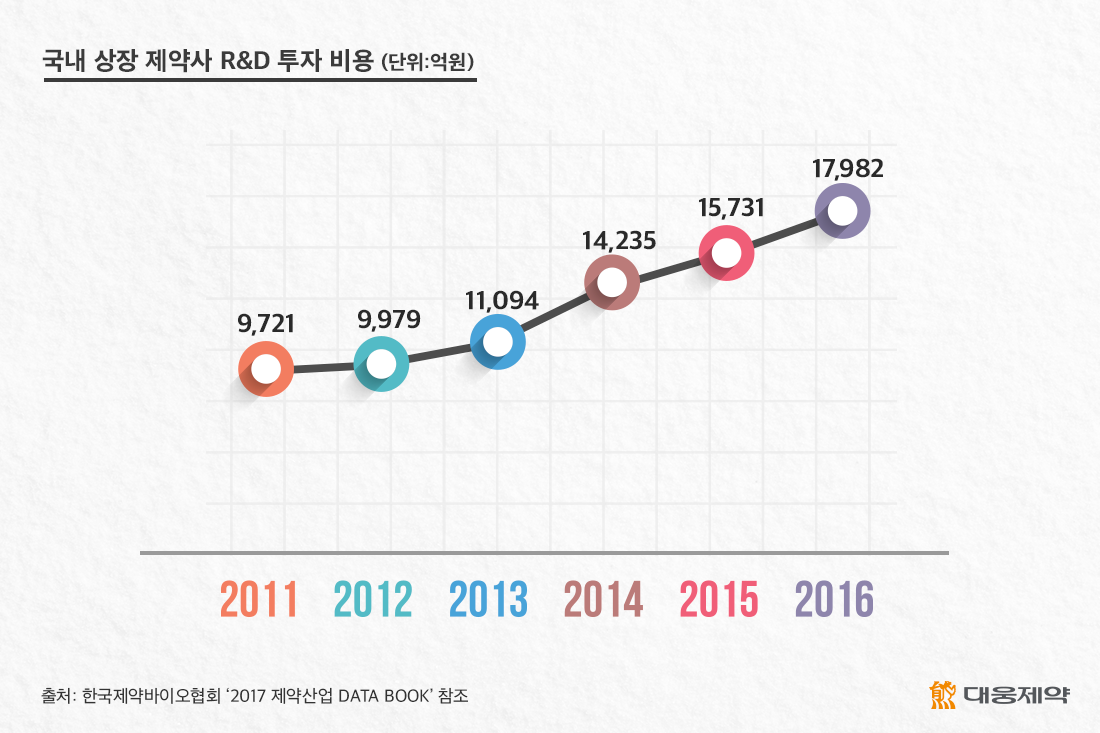
이런 가운데 지난 1월 22일 ‘글로벌 신약 기술수출 기업 현장 간담회’에 참석한 박능후 보건복지부 장관이 “신약개발은 10년 이상 시간이 필요하고, 신약후보물질 1만개 중 하나만 성공하지만, 일단 성공하면 폭발력이 큰 ‘하이 리스크-하이 리턴’ 산업이다. 그간 정부는 제약산업 지원을 위해 많은 육성책을 마련했다. 올해엔 AI 신약개발 사업 등 신규 R&D 예산을 책정하고 R&D 투자 및 세제 지원에 힘쓰겠다”고 강조했습니다.
정부와 업계의 노력으로 글로벌 신약이 탄생한다면, ‘글로벌 제약강국 한국’은 실현가능한 미래입니다. 한국 제약산업이 국가 경제 성장 동력으로 자리매김하고, 국민의 건강을 책임지는 대한민국 대표산업으로 거듭날 수 있도록 대웅제약이 앞장서겠습니다.
※ 본 기사는 ‘한국제약바이오협회’의 ‘2017 한국 제약산업 길라잡이’에서 발췌하여 재정리하였습니다.




