신약개발은 신약 후보물질 1만여 개 중 1개만이 성공할 수 있을 정도로 어려운 일이지만, 제약사들은 매년 엄청난 비용과 노력을 들여 신약 개발에 힘쓰고 있습니다. 그래서 대웅제약은 매년 매출의 10% 이상을 연구개발에 투자하고 있고, 최근 차세대 위식도역류질환 치료제 신약 개발의 성과가 가시화돼 주목받고 있는데요. 기존에도 위산분비억제제, 제산제, 점막보호제 등 다양한 치료제들이 출시되어 있지만, 기존 치료제가 가지고 있는 단점을 보완한 신약 개발에 힘쓰고 있습니다. 지난 11월 국내 임상 3상을 최종 완료해 식품의약품안전처에 품목허가를 신청한 상태이며, 내년에는 미국과 중국을 포함한 전세계 약 40조원에 육박하는 항궤양제 시장에 수출하기 위해 적극적인 임상 시험 진행 등을 목표로 하고 있답니다.
대웅제약, 펙수프라잔 글로벌 진출을 통한 기대
차세대 위식도역류질환 치료제 ‘펙수프라잔’을 의약품 시장 규모가 큰 미국과 중국을 시작으로 해외 시장에 수출하는 것을 목표로 역량을 집중하고 있습니다.
미국의 항궤양제 시장은 7.5조원 규모로 전 세계 시장의 21%를 차지하는 거대 시장인데요. 현재 대웅제약은 내년 초 미국에서 임상 1상을 진행하고, 내년 중 미국식품의약국에 3상 임상시험계획을 신청할 예정입니다. 앞서 지난 7월에는 미국식품의약국과의 사전 미팅을 통해 미국 시장 진출의 가능성을 확인하였답니다.
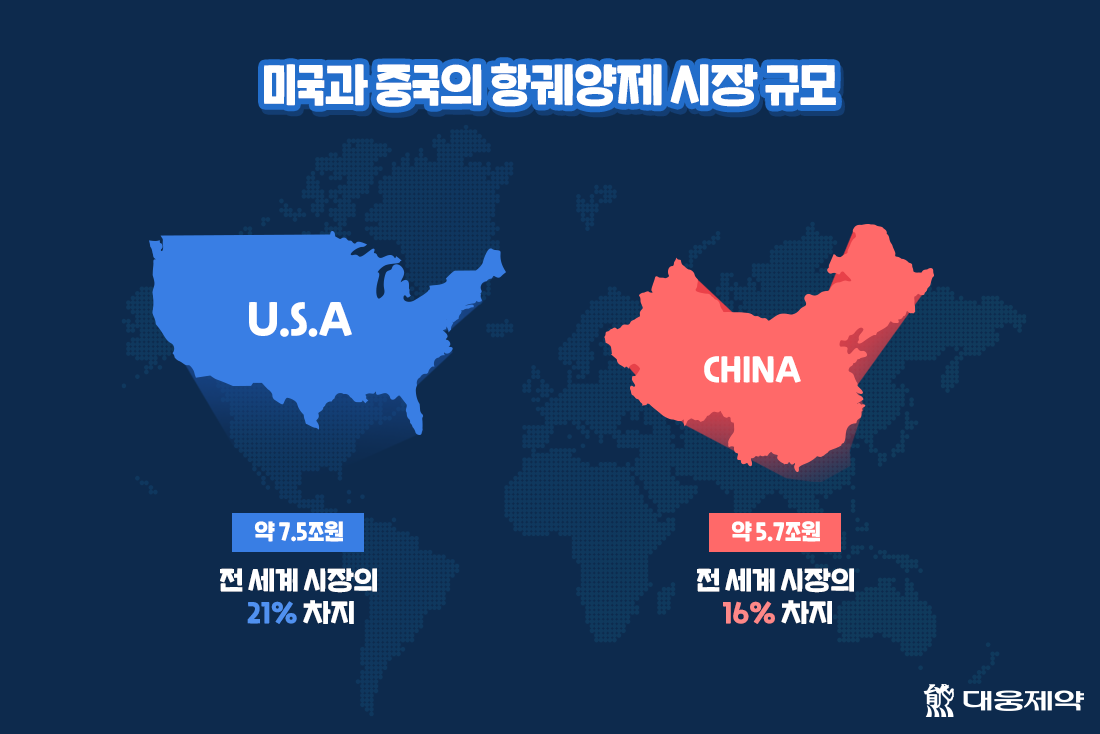
또한, 대웅제약은 내년 중 중국에서도 펙수프라잔의 임상시험계획을 신청할 계획인데요. 중국의 항궤양제 시장 규모는 5.7조원으로 전세계 시장의 16%를 차지하고 있습니다.
향후에는 진출 국가를 더욱 확대해 나갈 것을 목표로, 성공적인 해외 진출을 위해 국가별 시장 상황을 분석하고, 이에 맞춘 철저한 현지화 전략을 수립하고 있습니다.
펙수프라잔, 국내 임상 3상 완료로 신약 개발 결실 이뤄
그렇다면 차세대 위식도역류질환 치료제 ‘펙수프라잔’의 현재 임상 현황은 어떠할까요.
지난 11월 ‘펙수프라잔’의 국내 임상 3상이 완료돼 현재 식품의약품안전처에 미란성 위식도역류질환으로 품목허가가 신청된 상태로, 이는 대웅제약의 신약 과제 중 가장 빠르게 가시화된 성과인데요.
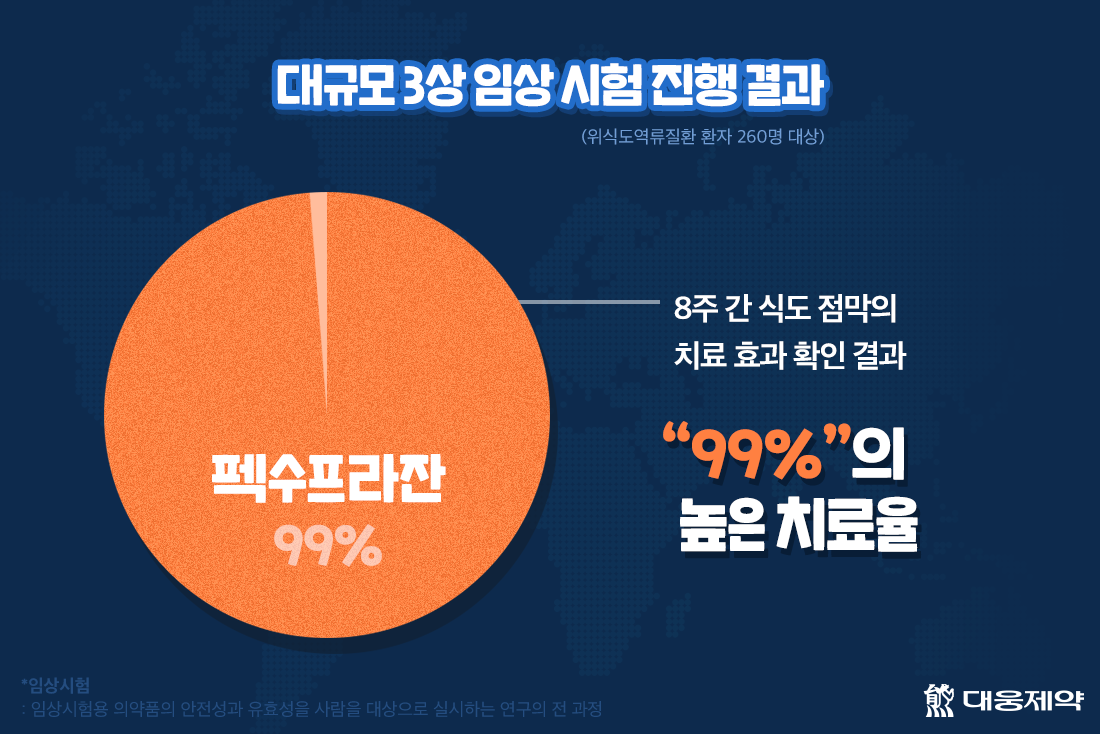
지난 2018년 10월부터 위산이 역류해 식도에 상처가 생기는 질환인 미란성 위식도역류질환 환자 260명을 대상으로 국내 25개 병원에서 대규모 3상 임상시험을 진행한 결과, 내시경으로 8주간 식도 점막의 치료 효과를 확인한 결과, 펙수프라잔은 99%의 높은 치료율을 나타냈고, 환자가 약을 복용할 때 불편함이나 부작용이 적은 점 또한 확인할 수 있었는데요.
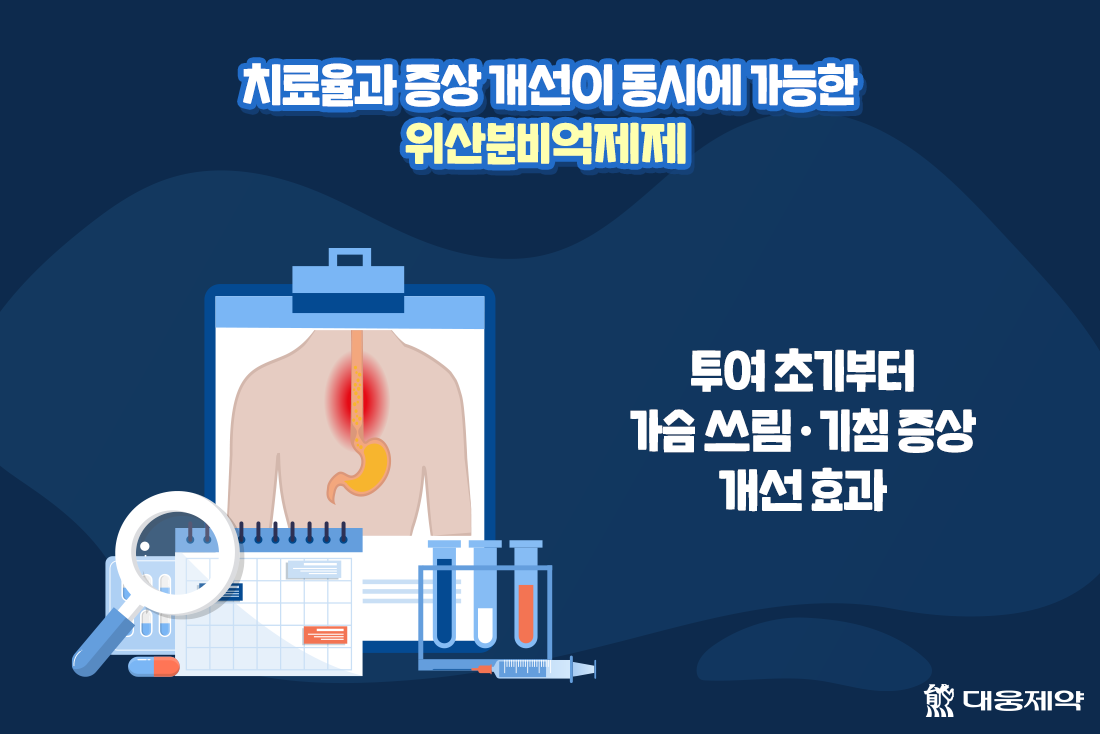
특히, 투여 초기부터 주•야간에 상관없이 즉시 가슴쓰림(heartburn) 증상 개선을 보이며, 역류성 식도염(GERD) 환자에게 간혹 나타나는 증상 중 하나인 기침(cough) 증상 개선 효과도 나타나는 등 치료율과 증상 개선을 동시에 할 수 있는 위산분비억제제 임을 확인했답니다.
앞으로 펙수프라잔을 계열 내 최고(Best-in-Class)의 위식도역류질환 치료제로 개발하기 위해 후속 적응증을 확보하고, 차별화 데이터를 확보하는 등 추가적인 연구개발에 R&D 역량을 집중할 계획입니다.
또한, 향후 끊임 없는 신약개발을 통해 위식도역류질환과 그 외 많은 질병에서 자유로워지는 그날까지 의약보국의 사명을 전하겠습니다.
-
연관 콘텐츠
-
최신 콘텐츠




