
대웅제약이 5년간의 독자적인 R&D를 통해 개발한 보툴리눔 톡신 제제 ‘나보타’가 지난 2월 1일 미국 FDA의 승인을 받는 쾌거를 이뤘습니다. 세계 최대 보툴리눔 톡신 시장인 미국에 본격적으로 진출이 가능하게 된 것이죠. 국산 보툴리눔 톡신 최초로 나보타가 까다로운 FDA 승인을 획득하게 된 배경에는 30년 역사에 이르는 대웅제약의 R&D 저력이 있습니다.
대웅제약은 NEXT 나보타를 만들기 위해, 지금도 끊임없이 신약 연구개발에 주력하고 있는데요. NEXT 나보타의 유력 후보 중 하나가 바로 안구건조증 치료제 HL036입니다.
대웅제약과 한올바이오파마가 낳은 황금알, HL036
HL036은 대웅제약과 자회사인 한올바이오파마가 공동개발 중인 안구건조증 치료제입니다. 안구건조증은 눈물생성이 부족하거나 눈물이 과도하게 증발하여 안구 표면이 손상되어 나타나는 질환으로, 눈물 내의 삼투압 증가와 염증물질의 축적에 의해 발생하는 것으로 알려져 있습니다.
HL036은 ‘anti-TNF 항체’가 기본물질로, 안구에서 염증을 유발하는 TNFα를 억제하는 새로운 작용기전을 가지고 있는 것이 특징인데요. HL036은 anti-TNF 항체를 국소질환에 사용할 수 있도록 개량하였고, 점안제 제제로 투여하는 방식으로 한올바이오파마의 단백질 치환기술인 ‘레시스테인(Resistein)’ 기술을 활용했습니다.

시장조사기관인 ‘퓨처 마켓 인사이트(Future Market Insights)’에 따르면 안구건조증은 2017년 기준 세계 4조원의 시장규모를 가지고 있으며, 스마트폰 과다 사용 · 미세먼지 등 환경변화에 따라 매년 7%씩 성장하고 있어 2027년에는 7조원으로 시장규모가 확대될 것으로 전망했습니다. 또한 시장조사기관 ‘마켓 스코프(Market Scope)’는 안구건조증 환자는 전 세계 3억명에 달하지만, 그 중 17%의 환자만이 치료를 받고 있는 것으로 분석했습니다.
현재 전세계에 시판되어 있는 안구건조증 치료제는 엘러간의 ‘레스타시스’와 샤이어의 ‘자이드라’, 산템의 ‘디쿠아스’ 등 3개의 품목으로, 현재까지 미국 FDA 허가를 받은 제품은 ‘레스타시스’와 ‘자이드라’가 전부입니다.
이처럼 전세계 시장 규모는 지속적으로 성장하고 있지만 경쟁제품이 많지 않은 독과점 형태의 시장으로, HL036이 개발된다면 글로벌 시장에서도 큰 성공을 거둘 수 있는 대웅제약과 한올바이오파마의 첫 합작품이 될 것이라 기대되고 있습니다.
임상으로 입증된 우수한 효과
무엇보다 HL036은 임상 진행속도가 빠르면서 임상결과 데이터도 우수하여 국내 바이오 애널리스트들이 계산한 ‘현재가치(Net Present Value, NPV)’가 무려 약 9,380억원~1조 430억원에 달하는 등 업계의 주목을 받고 있습니다.
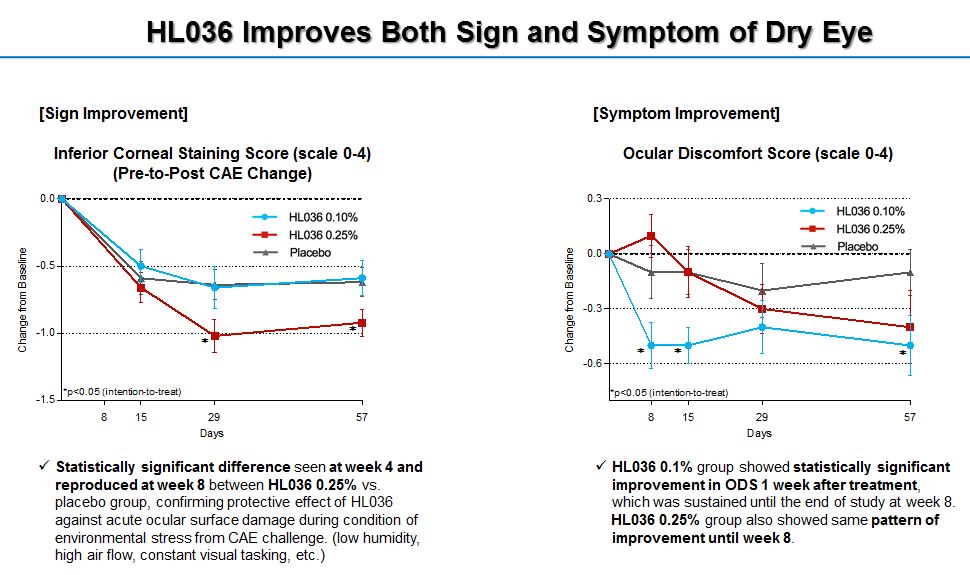
임상 1상 시험은 서울대학교병원 임상시험센터에서 진행해 안전성, 국소내약성 등에 문제가 없음을 확인했고, 임상 2상의 경우 미국에서 150명의 환자를 대상으로 글로벌 임상을 진행했는데요. 지난 2017년 11월부터 2018년 5월까지 진행한 임상 2상에서, 건조환경에 노출되기 전후의 객관적인 안구건조증 징후인 ICSS(Inferior Corneal Staining Score) 와 주관적 증상인 ODS(Ocular Discomfort Score)에서 모두 위약 대비 빠른 개선효과를 확인했습니다. 대웅제약과 한올바이오파마는 HL036 임상 2상 결과를 지난 10월 시카고에서 개최된 미국안과학회에서 발표하며, HL036의 효능과 안전성에 대한 데이터를 전세계에 알렸는데요. 이번달 캐나다에서 개최되는 세계안과 및 시기능학회 2019(ARVO 2019)에 참가하여 임상 2상 최종 결과를 발표할 예정입니다.
그리고 지난 3월, HL036은 드디어 글로벌 임상3상에 돌입하게 되었는데요. 대웅제약과 한올바이오파마는 HL036의 임상3상(임상명: VELOS-2)을 미국 임상정보 사이트에 등록하고, 3월부터 오는 12월까지 미국 내 11여개 지역에서 임상시험을 실시할 계획입니다. HL036 임상3상은 안구건조증 환자 630명을 대상으로 0.25% 점안액을 1일 2회, 8주 동안 안구에 투약하여 위약군 대비 효능과 안전성을 비교 평가하게 됩니다. 그리고 올해 12월말까지 Topline data를 도출할 예정입니다.
대웅제약은 한올바이오파마와 함께 HL036 신약개발을 통해 그동안 환자들이 제한적으로 선택할 수 밖에 없었던 안구건조증 치료제의 선택지를 넓히고, 우수한 약효와 안전성을 확보해 국민의 삶의 질 개선에 기여할 수 있도록 최선을 다하고 있습니다.




